AE Domain
AE的定义
“any untoward medical occurrence in a patient or clinical investigation subject administered a pharmaceutical product and which does not necessarily have to have a causal relationship with this treatment” (ICH E2A). 节选自ICH的话,可以看出AE指发生的任何不良医疗事件,不一定与治疗有因果关系。
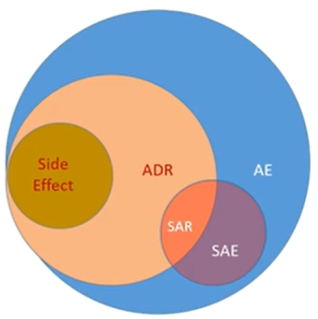
AE: adverse event 不良事件
ADR: adverse drug reaction 不良药品反应
SAE/SAR: serious adverse event/reaction 严重不良事件/反应
side effect: 副作用
| Variable | Comments | ||||||
|---|---|---|---|---|---|---|---|
| AEREFID | 如可以放SAE编号 | ||||||
| AETERM | topic变量;req变量; AE domain仅展示真实发生了的AE,所以不存在–OCCUR, –STAT,–REASND等变量; AE的记录:一般是当AE发生了任何变化(严重程度,相关性,采取的措施,转归等),都需要重新记录一条AE |
||||||
| AEPRESP | CRF预设了一些关注的AE,设置AEPRESP=Y; 由于AE只能放真实发生的AE,当这些被关注的AE是否发生都想保留这部分信息,可在FA Domain中展示
|
||||||
AEBODSYS AESOC |
AE采用MedDRA编码,其中SOC是primary SOC,AE编码可以根据发病原因,也可以根据发病部位或目的进行编码,根据需要决定primary SOC。而AEBODSYS根据sponsor需求决定,并不一定是AESOC。 | ||||||
| AETOXGR | 根据CTCAE收集的严重程度,设置成级别中的数,如 GRADE 2,则 AETOXGR = 2. | ||||||
| AEOUT | 不良事件应随访至事件解决或恢复都基线时的状态或稳定。 失访受试者:应填写失访前最后一次获得信息而非”未知”;当AE发生后没有检查或访视才记录为”未知”。 死亡受试者:死亡本身不应作为一个AETERM,死亡是结局,导致死亡的原因才是AETERM。只有当该AE导致的死亡才记录结局为”死亡”。 |
||||||
| AESTDTC | 症状,体征或检查异常的发生时间,而非诊断时间(有一定滞后) AE的采集从签署知情同意书就开始 SAE的开始日期时间应该为该AE的开始日期时间而非达到SAE标准的时间,如发生了AE(时间1),然后选择去住院(时间2)(达到SAE标准),应选择前者时间1。 |
||||||
| AEACN | 针对该AE采取的措施。有对应的CT[ACN],1. 无变化,2. 剂量增加,3. 给药速率降低,4. 剂量减少,5. 暂停给药,6. 停药,7. 不适用。 case1: 给药延迟(dose delay)应属于暂停用药(DRUG INTERRUPTED)。 case2: 受试者发生3级AE而后恢复正常。研究者考虑上一次AE较为严重,下一次研究用药剂量减少,针对该3级AE的AEACN应记录为”无变化”。采取的措施是预防,避免再次发生SAE,而不是针对该AE的措施。 case3: 如果连续的采取了多个措施,比如先研究用药减量,然后速率降低,后来暂停用药,一般取最后一次采取的措施。 |
||||||
| AEENDTC | 痊愈或痊愈有后遗症的日期 AE导致死亡的死亡日期 好转或未好转,AE未结束,置空AEENDTC,此时可通过AEENRTPT,AEENTPT结合使用来描述这类信息。 |
||||||